中藥批準上市耗時長于化藥及生物藥——2015年我國藥品受理審批情況回顧之批準上市篇
- 作者:汀汀
- 來源:中國醫藥報
- 2016-03-01 15:03
根據咸達數據統計(本文中的上市批準統計時間節點均以制證完畢,已發批件的時間節點為主),對2015年我國藥品受理審批情況回顧分析如下。
化藥
化藥獲批上市共94個制劑產品(未計算補充申請),具體如下圖所示。其中,6類批準的制劑數量最多,有54個,3.1類緊隨其后,有14個。另外,批準的5類、3.2類、3.3類以及1.5類化藥產品按個位數計。進口產品共計10個制劑被批準上市。
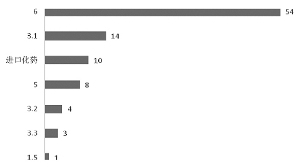
圖:化藥中各個類別被批準生產的制劑數量(個)
1類藥 2015年僅有一個1類藥獲批上市,為重慶華邦制藥股份有限公司所研發的1.5類新藥他扎羅汀培他米松乳膏。該產品2012年4月申報上市,歷時3年獲批上市。
3類藥 3類藥中,共有21個制劑獲批,其中3.1類14個,3.2類4個,3.3類3個。
3.1類獲批的制劑有:湖南方盛的阿德福韋酯分散片,福建天泉藥業的奧美沙坦酯膠囊與奧美沙坦酯片,遼寧海思科的精氨酸谷氨酸鹽注射液,內蒙古白醫制藥的門冬氨酸鉀注射液,北京四環科寶制藥的米格列奈片,山東魯抗辰欣藥業的溴芬酸鈉滴眼液,河北愛爾海泰制藥的鹽酸奧普力農注射液,正大天晴的鹽酸帕洛諾司瓊膠囊,昆明積大藥業的鹽酸帕洛諾司瓊注射液,河北奧星集團的鹽酸替利定片,石藥集團的鹽酸頭孢卡品酯片,山東羅欣的注射用雷貝拉唑鈉,以及珠海聯邦的左乙拉西坦片。這些產品中,最早申報上市的是福建天泉的奧美沙坦酯片與膠囊,于2010年4月申請;最遲申報的是內蒙古白醫制藥的門冬氨酸鉀注射液,于2013年申請。2015年獲批品種主要由2010~2013年申報上市的產品組成,平均等待批產時間為3年。2015年8月藥品審評審批新政之后,臨床審批時間明顯加速,而上市審批是否會做相應的調整,還需監測更多的數據來說明。
目前,依然有18個3.1類產品在生產現場檢查之中,鹽酸帕洛諾司瓊注射液、米格列奈片、米格列奈膠囊等2015年已批準的品種赫然在列。其中,鹽酸帕洛諾司瓊注射液已經有11家被批準上市,17家等待批產,還有41家在等待批準臨床,真可謂前赴后繼;米格列奈片的申報之路同樣擁擠:已經有7家批準上市,另外10家等待批產,32家在等待臨床批件。同類產品的批產新政 之后是否會收窄,我們靜觀其變。
3.2類獲批的制劑有:哈爾濱三聯藥業的氨酚曲馬多片,廈門恩成制藥的奧美拉唑碳酸氫鈉膠囊,山東羅欣藥業的羅紅霉素氨溴索片,四川科倫的復方醋酸鈉林格注射液。
3.3類獲批的制劑有:海南海神同洲制藥的硝酸舍他康唑栓,湖北荷普藥業的注射用蘭索拉唑,四川沱牌藥業的平衡鹽沖洗液。
進口藥 2015年共有10家企業的10個制劑產品被批準進口。分別為:參天制藥的他氟前列素滴眼液,諾華的門冬氨酸帕瑞肽注射液,輝瑞的阿昔替尼片,強生的醋酸阿比特龍片,施維雅的鹽酸伊伐布雷定片,拜耳的利伐沙班片,昆泰的布林佐胺噻嗎洛爾滴眼液,樂信藥業的復方沙芬那敏糖漿,Almirall的酒石酸西尼必利片,SHS international limited的腸內營養粉劑。進口的品種往往都是獨家品種,批準上市的廠家僅此一家。但2015年獲批的品種中也有兩個熱門品種:鹽酸伊伐布雷定片,已經有3個廠家申報上市,17個廠家申報臨床;而大熱品種利伐沙班片已經有33個廠家申報上市,另外還有13個廠家在申報臨床。所以,面對這種大品種的選擇必須理智,否則到研發后期就會遭遇競爭擁擠。
6類藥 6類產品是申報最多的品類,也是被批準上市最多的品類。2015年,已有多個廠家上市但還有廠家在等待批準上市的制劑品種有:頭孢羥氨芐膠囊、注射用鹽酸頭孢吡肟、注射用克林霉素磷酸酯、注射用頭孢地嗪鈉、注射用頭孢鎂唑鈉等抗生素類產品。無論批了多少,這些產品可能在未來都要面臨一致性評價。
而對于另外一些熱門品種,也已經有多個廠家獲批:阿托伐他汀鈣,37個廠家申報上市,5個廠家申報臨床,已經有18個廠家被批準上市;恩替卡韋,58個廠家申報上市,19個廠家申報臨床,已經有16個廠家被批準上市;硫酸氫氯吡格雷,56個廠家申報上市,已經有20個廠家被批準上市。
但從2015年被批準的6類產品來看,也不乏一些生產企業較少、生物等效性(BE)試驗申請也較少的產品,例如:豪森的利奈唑胺注射液,恒瑞的釓特酸葡胺注射液注射液,石藥的注射用萘夫西林鈉,煙臺魯銀藥業的硝呋太爾陰道片,珠海麗達藥業的枸櫞酸雷尼替丁片。因此,同樣是6類產品,有的廠家就能找到差異化產品,從而遠離扎堆,而有的廠家只能一次又一次地同別人踏入同一條河流。
生物藥
2015年,預防性生物制品共有3個產品(不包括補充申請)被批準上市,涉及2個廠家共計3個文號,分別是中國醫學科學院醫學生物學研究所的腸道病毒71型滅活疫苗以及Sabin株脊髓灰質炎滅活疫苗,沃森生物的吸附無細胞百白破聯合疫苗。
治療性生物制品共有8個產品(不包括補充申請)被批準上市,涉及8個廠家10個文號,無進口品種獲批。分別是:瀚邦醫療科技的豬源纖維蛋白黏合劑,海正的注射用重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白,銘康生物的注射用重組人組織型纖溶酶原激活劑TNK突變體,齊魯制藥的聚乙二醇化重組人粒細胞刺激因子注射液,丹霞生物的乙型肝炎人免疫球蛋白,金賽藥業的注射用重組人促卵泡激素,上海生物制品的狂犬病人免疫球蛋白以及上海新興醫藥的人凝血因子(Ⅷ)。
從產品的類型上看,申報數量較多的依然為研究較為成熟的免疫球蛋白以及疫苗類,例如:乙型肝炎人免疫球蛋白、狂犬病人免疫球蛋白、吸附無細胞百白破聯合疫苗、人凝血因子(Ⅷ)等,該類品種上市廠家數量在8~22個左右,而2015年沒有一個單抗產品獲批。
從申報和批準時間來看,最早申報的為廣州銘康生物的注射用重組人組織型纖溶酶原激活劑TNK突變體,2009年申報上市,2015年獲批,歷時6年;而被批準最快的是浙江海正的注射用重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白,2013年申請,2015年獲批,長于平均18個月的水平。生物藥與化藥的批準上市時間并未由于申報項目數量而有顯著不同。
中藥
2015年共有36個中藥產品獲批上市(不包括補充申請)。
從產品上來看,獲得乳癖舒片上市批準的廠家最多,其次是地榆升白膠囊,接下來是調經祛斑片。
從公司獲批情況來看,分散度較高,69個廠家中只有6家擁有1個以上的上市批件,他們分別是:江蘇晨牌藥業的宮炎平膠囊及骨質寧擦劑,天津和治藥業的乳癖舒片以及復方青黛片,江西藥都仁和制藥的乳癖舒片及腦康泰片,貴州益佰制藥的乳癖舒片及地榆升白膠囊,湖南方盛制藥的金剛藤咀嚼片及金剛藤分散片,長白山制藥的蒺藜腦通膠囊以及蒺藜果總皂苷。
從申請時間上來看,被批準最早的是2004年進行的上市申請,四川奇力制藥的地榆升白膠囊;最晚的是魯南厚普制藥的運腸膠囊,2011年進行的上市申請。被批準的產品主要集中在2005~2006年這個時間段進行的上市申報。由此可以看到,中藥的批準上市耗時比化藥以及生物藥更長。(本稿件由咸達數據提供)
(責任編輯:)
×
右鍵點擊另存二維碼!
網民評論
歡迎
登錄
-
為你推薦
互聯網新聞信息服務許可證10120170033
網絡出版服務許可證(京)字082號
?京公網安備 11010802023089號 京ICP備17013160號-1
《中國醫藥報》社有限公司 中國食品藥品網版權所有


dac00ec8-88f7-45fd-9248-d0bb4b6a357e_260x150c.jpg)




