生物醫藥|2020年生物醫藥注冊受理及審批情況分析
- 2021-04-08 13:44
- 作者:俞益秀 陳淑琳 甘娜娜
- 來源:火石創造
從全球來看,生物藥市場占比呈現逐漸提升的趨勢。2019年全球生物藥市場規模為2928億美元,預計2025年市場規模將達5445億美元,期間復合增長率達到10.9%,相對整體醫藥市場增速繼續維持快速增長。從國內來看,生物藥市場具有強勁的增長潛力,2019年市場規模達3172億元,隨著未來可支付能力提高、醫保覆蓋范圍增大、研發投入增加,生物藥市場規模將進一步擴大。
筆者在此對2020年國家藥監局藥審中心(CDE)受理生物藥注冊及審批情況進行簡要分析。
疫苗
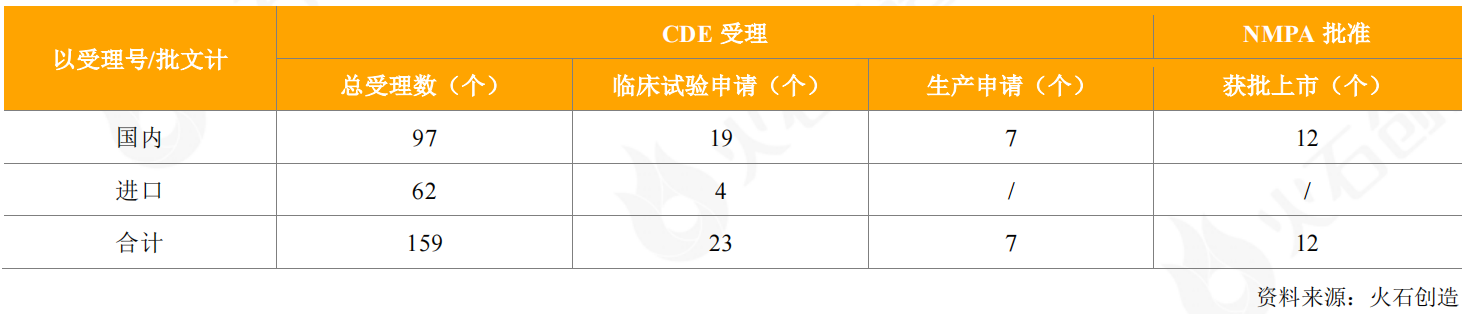
2020年,CDE共受理159個疫苗申請(國內97個、進口62個),涵蓋肺炎球菌、腦膜炎、流感病毒、狂犬疫苗以及近年比較熱的人乳頭瘤病毒(HPV)等多個領域,其中包括19個國產疫苗、4個進口疫苗的臨床試驗申請,7個國產疫苗的生產申請獲得受理,無進口疫苗申請銷售。
表1:2020年CDE受理和獲批上市疫苗情況
2020年,國內獲批上市國產疫苗10種,共12個批件,涉及流感、百白破、腦炎等疫苗。其中,百克生物的凍干鼻噴流感減毒活疫苗是國內首款獲批上市的采用鼻腔噴霧給藥方式接種的流感疫苗,此前國內批準上市的流感疫苗均采用肌肉注射方式接種。
表2:2020年新獲批上市的國產疫苗情況

新冠肺炎疫情的影響下,我國研發實力進一步凸顯。早在疫情暴發初期,我國就布局了5條技術路線開展新冠病毒疫苗研究。2020年12月31日,國藥集團中國生物新冠滅活疫苗已獲得國家藥監局批準附條件上市。
抗體藥物
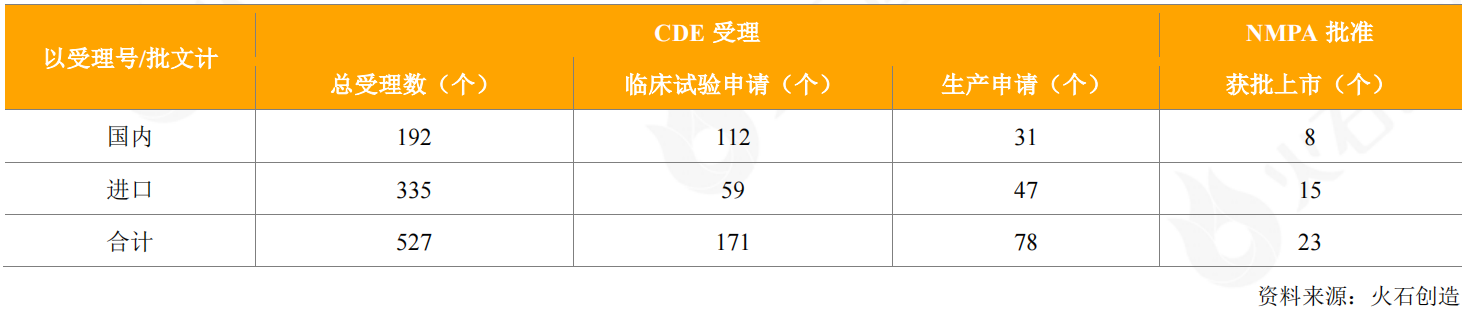
2020年,CDE共受理了527個抗體藥物的申請(國內192個和進口335個),其中包括112個國產抗體藥物、59個進口抗體藥物的臨床試驗申請,以及31個國產抗體藥物、47個進口抗體藥物的生產(銷售)申請。
表3:2020年CDE受理和獲批上市抗體藥物情況
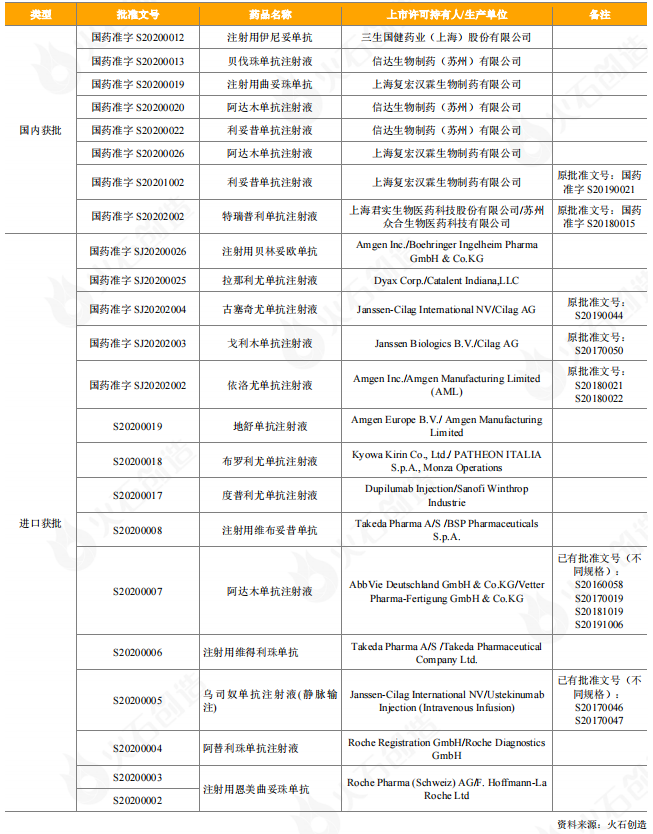
從獲批上市的情況看,2020年有8個國產單抗藥物獲批上市,其中6個單抗藥物為2020年首次獲批上市,包括三生國健的2類新藥伊尼妥單抗,信達生物的3款生物類似藥貝伐珠單抗、阿達木單抗、利妥昔單抗,復宏漢霖的阿達木單抗、曲妥珠單抗。2020年有多個重磅進口藥獲批上市,在14個獲批上市的進口單抗藥物中(15個批件),有9個藥物為2020年首次獲批。百濟神州引進的安進生物注射用貝林妥歐單抗獲批上市,是全球首個且唯一的CD3-CD19雙特異性抗體,用于治療成人復發或難治性前體B細胞急性淋巴細胞白血病(ALL);安進生物的地舒單抗注射液,是中國首個、目前唯一一個用于骨質疏松癥治療的抗RANKL單抗類藥物,可幫助絕經后婦女顯著降低椎體、非椎體及髖部骨折的發生風險;武田中國旗下的注射用維布妥昔單抗是全球首個、也是目前唯一一個以CD30為靶點的抗體偶聯藥物,注射用維得利珠單抗是目前炎癥性腸病(IBD)領域唯一的腸道選擇性生物制劑;恩美曲妥珠單抗是由羅氏和ImmunoGen共同研發的抗HER2靶向藥物曲妥珠單抗與抑制微管聚集的化療藥物美坦新(DM1)通過硫醚連接子連接而成的抗體偶聯物(即ADC藥物)。
表4:2020年獲批上市抗體藥物情況
從臨床試驗申請獲得受理的情況來看,君實生物、恒瑞醫藥、百濟神州、信達生物等國內企業表現突出。國外巨頭羅氏、諾華、默沙東多款產品獲得受理,如羅氏的PD-L1抗體阿替利珠單抗、默沙東的帕博利珠單抗注射液。
從上市申請獲得受理的情況來看,君實生物的特瑞普利單抗注射液上市申請獲得受理;勃林格殷格翰、葛蘭素史克、羅氏等跨國企業的30個進口單抗藥物(47個受理號)的上市申請獲得受理。
重組蛋白
2020年,我國批準上市的重組蛋白產品共有5個。另外,截至2020年底,CDE共新增受理了87個重組蛋白藥品的申請(國產61個,進口26個),國產重組蛋白批件中有43個藥品申請臨床試驗,已有24個獲得臨床批件,10個藥品申請上市,均處于審評審批階段;進口重組蛋白批件中,2個為申請銷售,尚未獲批上市,另有2個申請臨床,1個獲得了臨床批件。
表5:2020年CDE受理和獲批上市重組蛋白產品情況

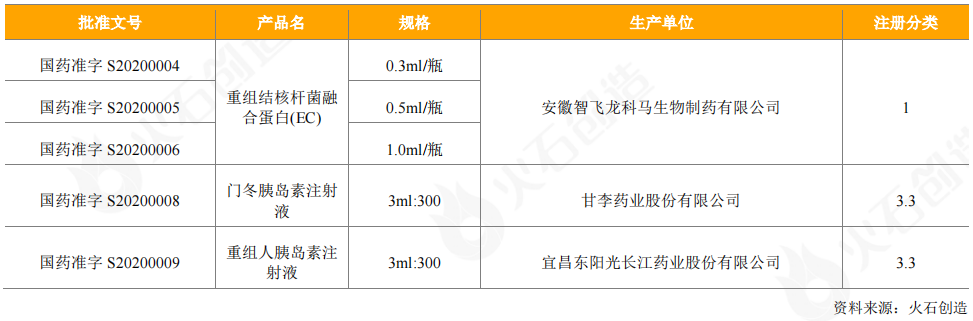
從獲批上市的情況看,2020年共獲批3個國產重組蛋白產品(5個批件),包括智飛龍科馬1類新藥重組結核桿菌融合蛋白(EC)3個品規,甘李藥業的門冬胰島素注射液和東陽光藥的重組人胰島素注射液。
表6:2020年新獲批上市國產重組蛋白產品情況
從申請獲得受理的情況看,CDE共受理31個國產重組蛋白產品的臨床試驗申請,共計43個受理號,已發24個批件;2個進口藥品申請臨床試驗,其中諾和諾德的Icodec胰島素注射液已獲批件,勃林格殷格翰的注射用替奈普酶在審評審批中。另外,CDE受理了7個國產重組蛋白產品的上市申請,共計10個受理號,均在審評審批中;1個進口產品的銷售申請,2個受理號,即諾和諾德的德谷胰島素利拉魯肽注射液,產品尚在審評審批中。
表7:2020年CDE受理重組蛋白產品情況
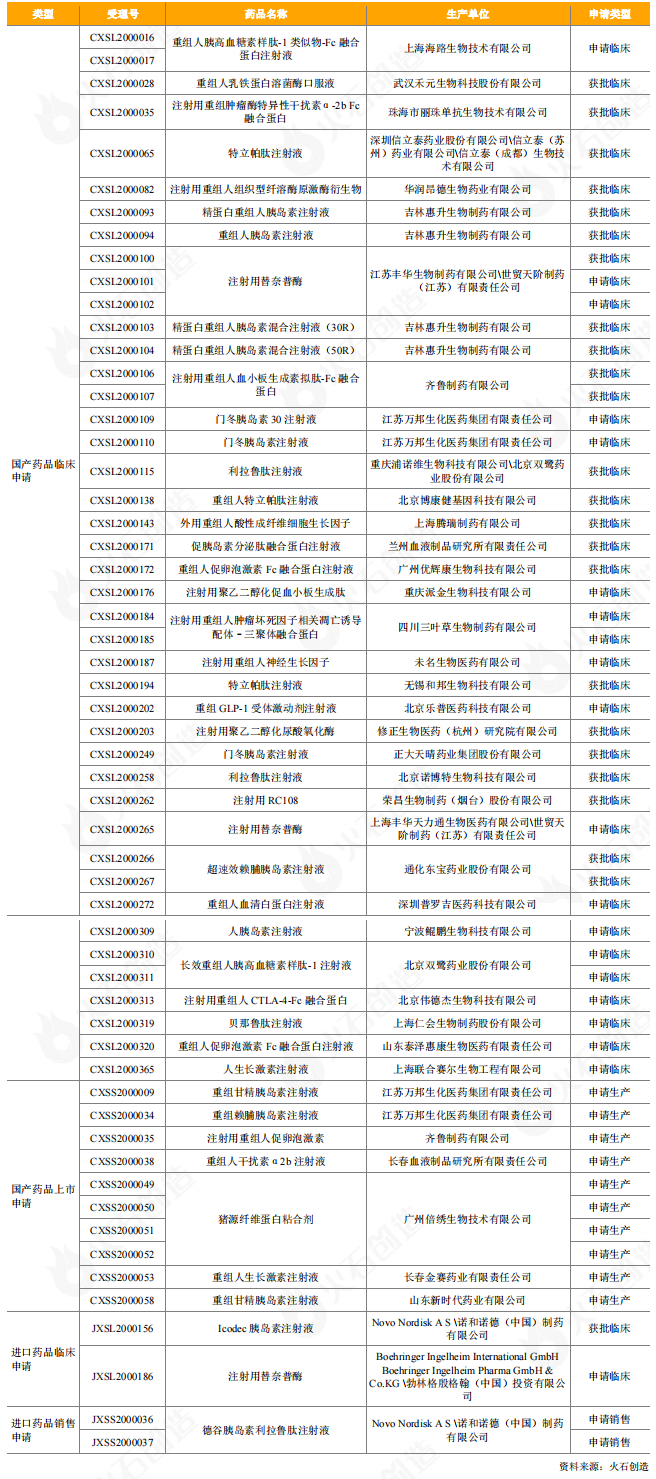
血液制品
2020年,CDE共批準上市血液制品8個,注冊分類均為3類;另外,CDE共受理了55個血液制品,有12個申請臨床(3個獲得臨床批件),9個申請生產/銷售(包括1個進口血液制品,人血白蛋白),目前處于審評審批階段。
表8:2020年CDE受理和獲批上市血液制品情況
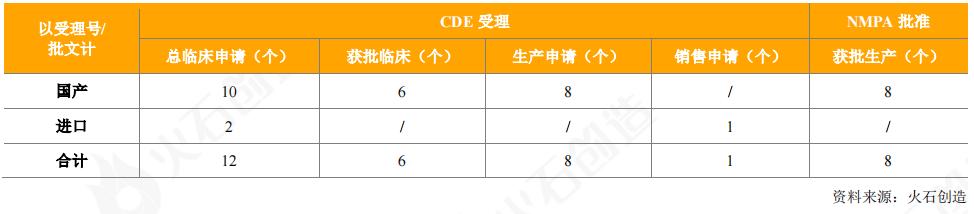
從獲批上市的情況看,2020年獲批上市血液制品5個,涉及8個批件,凝血因子類和免疫球蛋白類仍是血液制品獲批主體。
表9:2020年新獲批上市血液制品情況
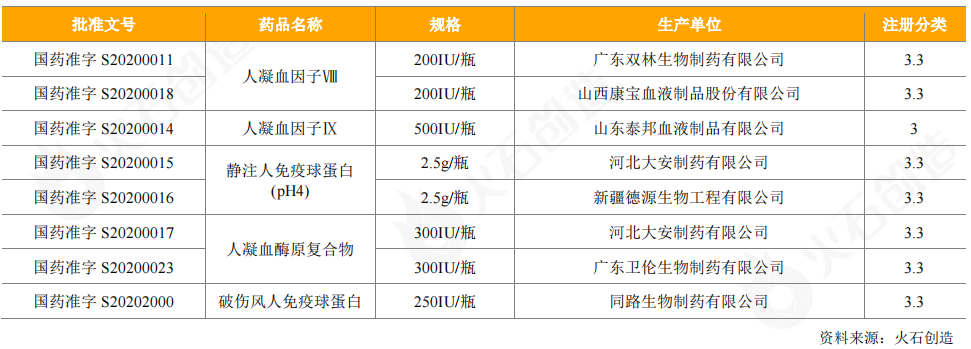
從受理情況來看,興科蓉醫藥進口Octapharma人血白蛋白的申請獲得受理,另有12個血液制品申請臨床試驗,8個血液制品申請生產,以免疫球蛋白類、凝血因子類為主。重組人凝血因子Ⅶa、Ⅶ以注冊分類2類藥獲批臨床或申請生產,申請廠家有正大天晴和成都蓉生;其余血液制品均以3類藥進行注冊;遠大蜀陽藥業的人凝血因子Ⅷ獲得優先審評。
表10:2020年CDE受理血液制品情況
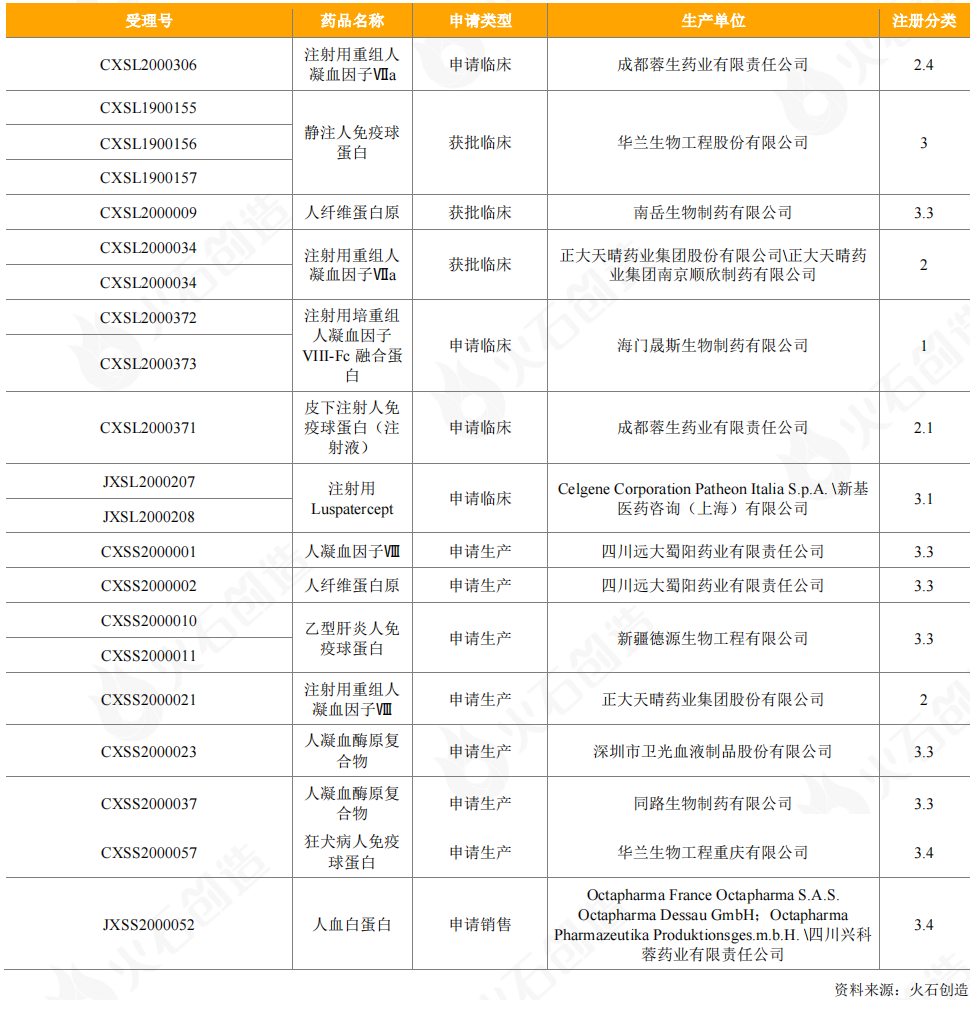
細胞和基因治療
2020年,國內CAR-T細胞療法產品接連提交上市申報。2020年2月26日,國內首個CAR-T細胞治療產品上市申請獲CDE受理,即復星凱特從KitePharma引進的抗人CD19CAR-T細胞治療產品益基利侖賽注射液(暫定);2020年6月30日,瑞基侖賽注射液(暫定)成為國內第2款申報上市的CAR-T療法,該產品是在美國Juno公司JCAR017基礎上,由藥明巨諾自主開發的靶向CD19的CAR-T療法。兩款CAR-T細胞療法產品均納入優先審評。
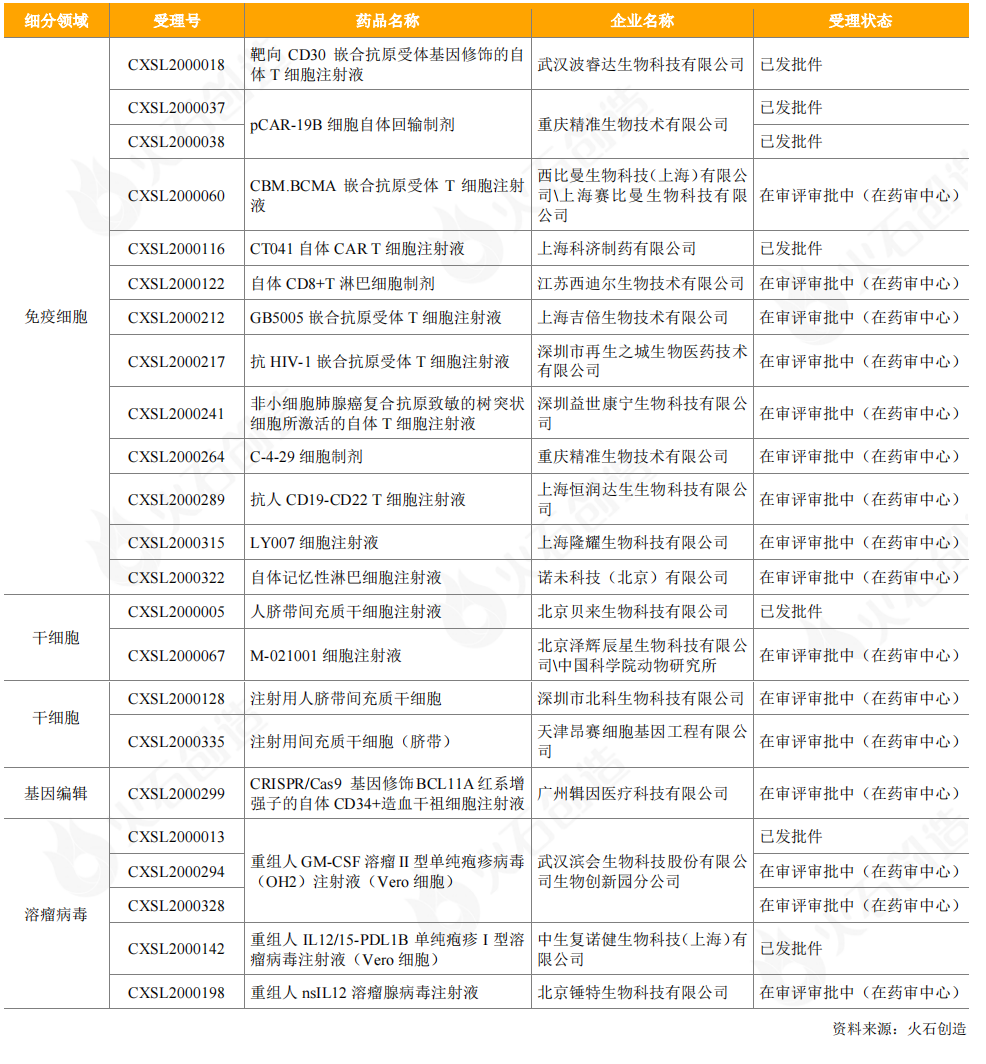
從臨床試驗申請來看,2020年CDE受理了1個進口細胞治療藥品,為天士力從全球領先干細胞研發公司Mesoblast引進的異體人骨髓間充質前體細胞產品。CDE受理的20個國產細胞和基因治療產品中,有免疫細胞產品12個,包括西迪爾生物的CTL細胞療法、隆耀生物的CTL細胞療法、益世康寧的ACTL細胞療法、諾未科技的NewishT自體記憶性淋巴細胞,以及恒潤達生(雙靶點)、波睿達生物(雙靶點)、重慶精準生物、再生之城、吉倍生物、科濟制藥、西比曼生物/賽比曼生物的CAR-T細胞產品;有干細胞產品4個,包括1個人胚胎干細胞產品和3個間充質干細胞產品;有基因治療產品4個,包括1個CRISPR/Cas9基因編輯療法產品和3個溶瘤病毒產品。
表11:2020年CDE受理的國產細胞和基因治療產品臨床試驗申請情況
《中國醫藥報》社版權所有,未經許可不得轉載使用。
(責任編輯:劉思慧)
右鍵點擊另存二維碼!
-
為你推薦












